1、小华称取55.0g氯酸钾和二氧化锰的混合物加热制取氧气,待固体质量不再改变后,她将剩余固体加到119.2g水中,充分搅拌后过滤,得到滤渣和一不饱和溶液,再将滤渣洗涤干燥后称得其质量为6.0g。请计算所得溶液中的溶质质量分数?
2、某化工产品的成分是氯化钾和氢氧化钾的固体混合物。20℃时在实验室里,甲、乙、丙3位同学分别取该固体样品放人锥形瓶中,然后再向锥形瓶中加人氯化铜溶液,振荡,充分反应后过滤,称量沉淀的质量,测得实验数据如下表所示:
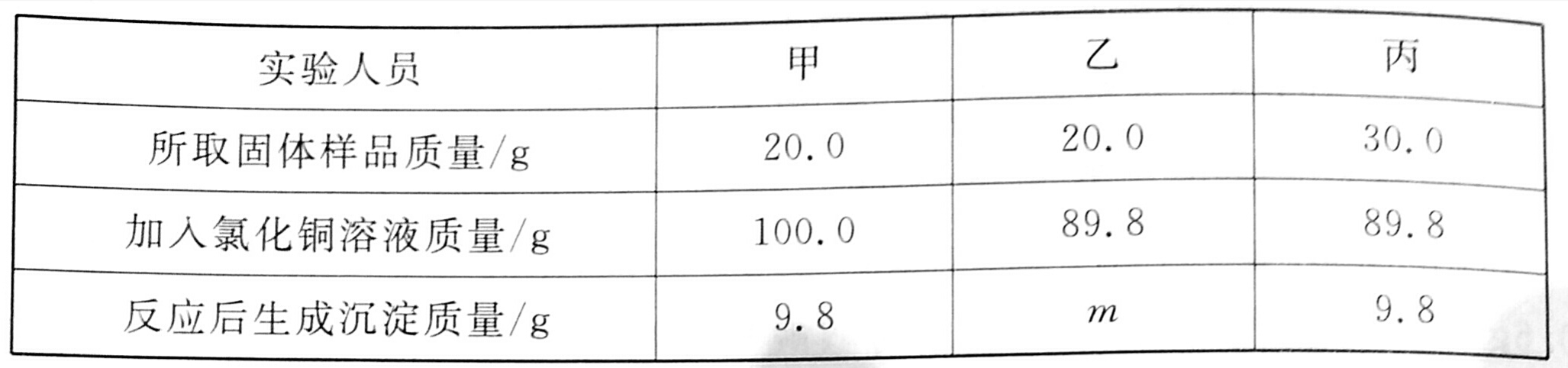
(1)表中m的数值为 _______ ; ______同学所做的实验中,反应物恰好完全反应。
(2)计算恰好完全反应时,所得溶液中溶质的质量分数。
【参考答案】
1、解:设氯酸钾完全分解生成氯化钾的质量为x
氯酸钾的质量为:55.0g—6.0g=49.0g
2KCIO₃=2KCl+3O₂↑(条件写:MnO₂ △)
245 149
49.0g x
245/149=49.0g/x
x=29.8g
所得溶液中溶质的质量分数为
29.8g/(119.2g+29.8g)×100%=20%.
答:所得溶液中溶质的质量分数为20%。
2、(1) 9.8 乙
(2) 乙中反应后溶液的质量为
20.0g+89.8g—9.8g=100.0g
溶质为氯化钾。设20.0g固体样品中含有的氢氧化钾质量为x,反应生成的KCl质量为y
CuCl₂+2KOH=Cu(OH)₂↓+2KCI
112 98 149
x 9.8g y
112/98=x/9.8g
x=11.2g
98/149=9.8g/y
y=14.9g
固体样品中氯化钾的质量为
20.0g—11.2g=8.8g
反应后溶液中含有的氯化钾的总质量为
8.8g+14.9g=23.7g
所得溶液中溶质的质量分数为
23.7g/100.0gx100%=23.7%
答:恰好完全反应时,所得溶液中溶质的质量分数为23.7%。
|

